المادة النقية هي المادة المتجانسة (أي لها نفس التركيب الكيميائي في جميع أنحاء المادة)، ويمكن أن توجد في ثلاث مراحل (غازية، سائلة، وصلبة). يمكن أن تساعد خصائص المواد النقية في فهم مبادئ الديناميكا الحرارية.
تشمل الخصائص الشائعة للمواد النقية ما يلي: درجة الحرارة والضغط والحجم والكتلة والكثافة والحجم النوعي والطاقة والمحتوى الحراري والانتروبيا. ويمكن تصنيف هذه الخصائص إما واسعة النطاق أو مكثفة. الخاصية المكثفة هي التي لا تعتمد على حجم النظام. درجة الحرارة مثال. الخصائص الشاملة هي تلك التي تعتمد على حجم النظام. وتشمل الأمثلة الكتلة والحجم.
ومن المصطلحات المهمة عند التعامل مع المواد النقية ما يلي:
- التبخير، وهي النقطة التي يتحول فيها السائل إلى مرحلة بخار
- التكثيف، وهو النقطة التي يتحول فيها البخار إلى حالة سائلة (وهي نفس نقطة التبخر)
- الانصهار، وهي النقطة التي تتحول فيها المادة الصلبة إلى سائلة
- التجمد، وهي المرحلة التي يتحول فيها السائل إلى مادة صلبة
- التسامي، وهو النقطة التي تتحول فيها المادة الصلبة مباشرة إلى بخار
- إزالة التسامي، وهي النقطة التي يتحول فيها البخار مباشرة إلى مادة صلبة (غير عادي ولكن يبدو أنه يحدث)
- النقطة الحرجة، هي النقطة التي يلتقي فيها منحني البخار المشبع والسائل المشبع ويصبحان شيئًا واحدًا.
- النقطة الثلاثية هي النقطة التي تتواجد فيها المراحل الصلبة والسائلة والغازية جميعها في نفس الوقت في حالة توازن.
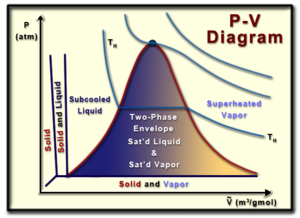
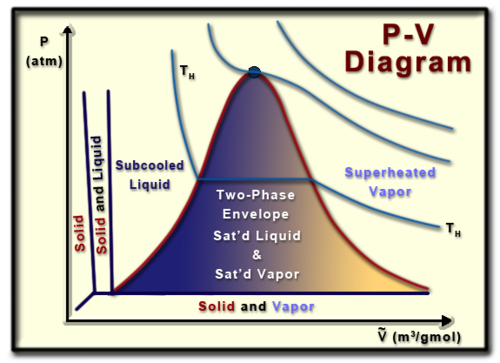
تفاصيل المخطط الكهروضوئي
مخطط حجم الضغط (أو مخطط PV) هو تمثيل مرئي للضغط وحجم مادة نقية معينة (مادة متجانسة). إن فهم المخطط الكهروضوئي مفيد في فهم خصائص المواد النقية، وهو جانب مهم من الديناميكا الحرارية.
بدءًا من أعلى الرسم البياني، النقطة الحرجة هي ذلك الموقع الذي لا يوجد فيه فرق بين الطور الغازي والطور السائل للمادة. عند هذه النقطة يصبح السائل المشبع والبخار المشبع هو نفس السائل، مما يؤدي إلى تساوي الحجم المولي للسائل المشبع والبخار المشبع.
يمثل الجانب الأيسر من منحنى الجرس خط السائل المشبع، بينما يمثل الجانب الأيمن من منحنى الجرس خط البخار المشبع. يقع السائل أو البخار المشبع على خطوطهما المناسبة، وهو بالضبط المكان الذي يتشبع فيه السائل أو يتبخر عند الضغط الموجود. داخل منحنى الجرس يوجد ما يسمى بغلاف الطور الثاني، حيث تتواجد الطور السائل والغازي للمادة في نفس الوقت. في هذه الحالة يقال أن المادة تتمتع بنوع من الجودة (x)، حيث تكون الجودة المئوية للمادة هي نسبة كمية البخار المشبع إلى الكتلة الإجمالية للمادة. ويمكن تعريف الجودة رياضياً بأنها:
الجودة لا يمكن أن تتجاوز 100%. في الغلاف ثنائي المرحلتين، من المهم أن ندرك أن درجة الحرارة والضغط يعتمدان. عند تحديد حالة المادة، لا يمكن تحديد الضغط ودرجة الحرارة في وقت واحد.
المعادلات
بالنسبة للمواد النقية، هناك بعض المعادلات المهمة التي يمكن فهمها من الرسم البياني Pv، أو تباينه في الرسم البياني Tv (درجة الحرارة - الحجم)، الرسم البياني PT (درجة الحرارة - الضغط)، وما إلى ذلك.
لتحديد الحجم الإجمالي للخليط، عليك أن تدرك أولًا أن هذا هو مجموع الحجم الذي يشغله السائل ومجموع الحجم الذي يشغله الغاز. ويمكن تعريف ذلك على النحو التالي:
mv = م و ت و + م ز v ز
يمكن تعريف حجم معين على النحو التالي:
الخامس = الخامس و +س*( الخامس -الخامس و )
أخيرًا، أدرك أن نسبة السائل بالكتلة يمكن فهمها على أنها 100(1-x) بينما يمكن فهم نسبة البخار على أنها 100x.
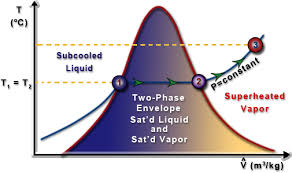
مخطط تلفزيوني
رسم بياني تلفزيوني يوضح العلاقة بين درجة حرارة المادة النقية وحجمها. المنحنيات الموجودة في هذا المخطط هي خطوط تساوي الضغط، أو خطوط الضغط الثابت. تحت الغلاف ثنائي الطور، على الرغم من أن المادة تتمتع بنوع من الجودة، إلا أنه يمكن قراءة الحجم المولي للبخار المشبع أو السائل عند ضغط معين مباشرة من الرسم البياني. أي أن خصائص السوائل المشبعة والأبخرة المشبعة لا تعتمد على الجودة.
في هذا الرسم البياني، على يسار الغلاف ثنائي الطور، ستكون المادة عبارة عن سائل مبرد (لأن درجة الحرارة ستكون أقل من درجة حرارة التشبع). على يمين الغلاف ثنائي الطور ستكون المادة عبارة عن بخار شديد الحرارة (لأن درجة الحرارة ستكون أكبر من درجة حرارة التشبع).
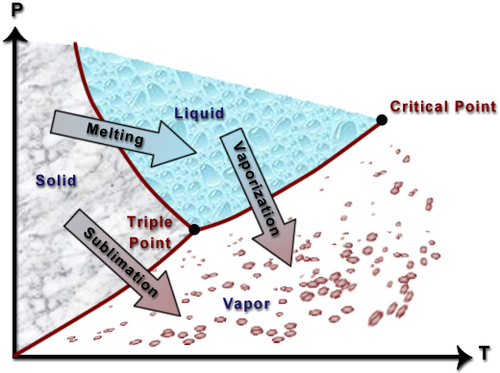
مخطط بي تي
يوضح مخطط PT علاقة المادة النقية بين الضغط ودرجة الحرارة. يعرض هذا الرسم البياني خصائص المادة التي تتمدد عند التجمد (مثل الماء).
وكما يمكن ملاحظة من هذا الرسم البياني، يوجد السائل عند ضغط أعلى من البخار (ضغط البخار). على هذا النحو يمكن الإشارة إلى السائل على أنه سائل مضغوط. يوضح اتباع الأسهم الموجودة على الرسم البياني ما يجب القيام به حتى يحدث تغيير في الطور. على سبيل المثال، لنفترض أن لديك ماءًا موجودًا في منتصف النطاق الصلب. إذا حافظت على ثبات الضغط ورفعت درجة الحرارة فقط، فإن المادة الصلبة سوف تذوب وتتحول إلى سائل. وبالمثل، بالنسبة لمعظم المنطقة السائلة، إذا انخفض الضغط مع الحفاظ على درجة الحرارة ثابتة، فإن السائل سوف يتبخر إلى غاز.
مراجع
جميع المعلومات الواردة في هذه الصفحة تأتي من www.learnthermo.com ومن "الديناميكا الحرارية للمهندسين، الطبعة الثانية"